
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
10-03-2025 - Chemistry Basics - Atomic Mass [EN]-[IT]
With this post I would like to give a brief instruction on the topic mentioned in the subject
(code notes: X_86)
Atomic Mass
Atomic mass is the measure of the mass of an atom.
The atomic mass derives from the weighted average of the masses of the isotopes of an element.
This measure is expressed in u where 1 u is defined as one twelfth of the mass of a carbon-12 atom.
Sum of masses, example
Let's take carbon-12 (C-12) as an example.
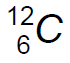
Carbon-12 is a stable isotope of carbon.
Here are its characteristics:
Mass number = 12 (6 protons and 6 neutrons)
Atomic number = 6 (6 protons in the nucleus)
Stability = stable isotope, meaning it does not undergo radioactive decay.
Abundance = Common isotope of carbon and represents almost 99% of all carbon present in nature.
To know how much a carbon-12 atom weighs, you need to add up all the constituent particles.
mp = proton mass = 1.67265x10^-24g
mn = neutron mass = 1.67495x10^-24g
mn = electron mass = 9.10953x10^-28g
Now let's calculate the mass of the atom referring to the characteristics of the atom...

atom mass = 6*(mp+mn+me) = 2.00910x10^-23g
Now we could also calculate how many carbon-12 atoms there are in 12 grams of substance.
To calculate how many atoms there are in a substance we must perform the following operation:
mass of substance / mass of single atom
in our case it will be as follows:
(12g) / (2.00910x10^-23g) = 5.97280x10^23 = 6x10^23 atoms
However, it must be said that the mass of the atom calculated as the sum of the masses of the constituent particles does not coincide with the actual mass.
This phenomenon is known as mass defect.
This is explained by Einstein's theory of relativity and the formula E = mc^2, which describes the relationship between energy (E) and mass (m).
When protons and neutrons combine to form a nucleus, a part of the mass of the constituent particles is converted into nuclear binding energy, which holds the nucleus together. This binding energy is necessary to overcome the electrostatic repulsion between the positive protons. Consequently, the total mass of the nucleus is less than the sum of the masses of the individual protons and neutrons.
In fact, our calculation presented a calculated mass that I report below
atom mass = 6*(mp+mn+me) = 2.00910x10^-23g
while in reality it is
effective mass (experimental measurements)= 1.99268x10^-23g
Atomic mass unit (a.m.u.)
We mentioned something at the beginning of the article, but now let's go into detail.
Representing the mass of the atom in grams risks having decidedly small numbers, so when we perform calculations we could be misled by operations with terms that are uncomfortable to handle.
It is therefore better to use a unit other than grams.
Then we thought about the following:
The mass of a carbon-12 atom is essentially provided by protons and neutrons (12 particles) since the contribution of electrons is negligible and it would be enough to divide the effective mass between the 12 particles.
Atomic mass unit (AMU) = mass of carbon-12 / 12 = 1.992684x10^-23/12 = 1.66057x10^24g
We can therefore say that 1 carbon-12 atom has a mass of 12 amu.
Curiosity
Why in the case of carbon do we read on the periodic table that the mass of an atom is equal to 12.011 amu.?
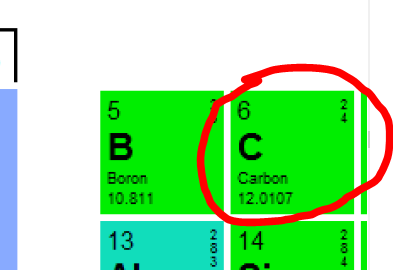
The main reason is that in nature there are 3 isotopes of carbon (C) and the atomic mass of carbon reported on the periodic table is a weighted average of the atomic masses of the individual isotopes.
From this it follows that:
*For each element present on the periodic table the masses reported are weighted averages of the masses of the isotopes of that element.
NOTE: An isotope is a variant of a chemical element that has the same number of protons (atomic number) but a different number of neutrons in the nucleus. For example, carbon has several isotopes, including carbon-12 (C-12) and carbon-14 (C-14). Both have 6 protons, but carbon-12 has 6 neutrons, while carbon-14 has 8.
Conclusions
To calculate the mass of an atom, it was agreed to use the unit of measurement a.m.u. (atomic mass unit). This avoids doing calculations with numbers that are extremely small and inconvenient to write or handle.
Question
Have you ever done any exercises to calculate the atomic mass of some chemical element or its isotopes?

[ITALIAN]
10-03-2025 - Basi di chimica - Massa atomica [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_86)
Massa atomica
La massa atomica è la misura della massa di un atomo.
La massa atomica deriva dalla media ponderata delle masse degli isotopi di un elemento.
Tale misura viene espressa in u dove 1 u è definita come un dodicesimo della massa di un atomo di carbonio-12.
Somma delle masse, esempio
Prendiamo come esempio il carbonio -12 (C-12).
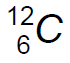
Il carbonio -12 è un isotopo stabile del carbonio.
Qui di seguito sono elencate le sue caratteristiche:
Numero di massa = 12 (6 protoni e 6 neutroni)
Numero atomico = 6 (6 protoni nel nucle0)
Stabilità = isotopo stabile, significa che non subisce un decadimento radioattivo.
Abbondanza = Isotopo comune del carbonio e rappresenta quasi il 99% di tutto il carbonio presente in natura.
Per sapere quanto pesa un atomo di carbonio -12 bisogna sommare tutte le particelle costituenti.
mp = massa protone = 1,67265x10^-24g
mn = massa neutrone= 1,67495x10^-24g
mn = massa elettrone= 9,10953x10^-28g
Andiamo ora a calcolare la massa dell'atomo riferendoci alle caratteristiche dell'atomo...

massa atomo = 6*(mp+mn+me) = 2,00910x10^-23g
Ora potremmo anche calcolare quanti atomi di carbonio -12 ci sono in 12 grammi di sostanza.
Per calcolare quanti atomi ci sono in una sostanza dobbiamo eseguire la seguente operazione:
massa sostanza / massa singolo atomo
nel nostro caso risulterà come segue:
(12g) / (2,00910x10^-23g) = 5,97280x10^23 = 6x10^23 atomi
Bisogna però dire che la massa dell'atomo calcolata come sommatoria delle masse delle particelle costituenti non coincide con la massa effettiva.
Questo fenomeno è noto come difetto di massa.
Questo è spiegato dalla teoria della relatività di Einstein e dalla formula E = mc^2, la quale descrive la relazione tra energia (E) e massa (m).
Quando i protoni e i neutroni si combinano per formare un nucleo, una parte della massa delle particelle costituenti viene convertita in energia di legame nucleare, che tiene insieme il nucleo. Questa energia di legame è necessaria per superare la repulsione elettrostatica tra i protoni positivi. Di conseguenza, la massa totale del nucleo è inferiore alla somma delle masse dei singoli protoni e neutroni.
Infatti il nostro calcolo presentava una massa calcolata che riporto qui di seguito
massa atomo = 6*(mp+mn+me) = 2,00910x10^-23g
mentre in realtà è
massa effettiva (misure sperimentali)= 1,99268x10^-23g
Unità di massa atomica (u.m.a.)
Abbiamo accennato qualcosa all'inizio dell'articolo, ma ora entriamo nel dettaglio.
Rappresentare la massa dell'atomo in grammi si rischia di avere dei numeri decisamente piccoli, quindi quando si effettuano calcoli potremmo traviarci davanti ad operazione con termini scomodi da maneggiare.
Conviene quindi usare una unità diversa dai grammi.
Allora si è pensato a quanto segue:
La massa di un atomo di carbonio-12 è fornita sostanzialmente dai protoni e dai neutroni (12 particelle) poiché il contributo degli elettroni è trascurabile e basterebbe ripartire la massa effettiva tra le 12 particelle.
Unità di massa atomica (U.M.A.) = massa carbonio -12 / 12 = 1,992684x10^-23/12 = 1,66057x10^24g
Possiamo quindi dire che 1 atomo di carbonio-12 ha una massa di 12 u.m.a.
Curiosità
Perchè nel caso del carbonio leggiamo sulla tavola periodica che la massa di un atomo è pari a 12,011 u.m.a.?

Il motivo principale è che in natura esistono 3 isotopi del carbonio (C) e la massa atomica del carbonio riportata sulla tavola periodica è una media pesata delle masse atomiche de singoli isotopi.
Da questo deriva che:
*Per ogni elemento presente sulla tavola periodica le masse riportate sono delle medie pesate delle masse degli isotopi di quell'elemento.
NOTA: L'isotopo è una variante di un elemento chimico che ha lo stesso numero di protoni (numero atomico) ma un diverso numero di neutroni nel nucleo. Per esempio, il carbonio ha diversi isotopi, tra cui il carbonio-12 (C-12) e il carbonio-14 (C-14). Entrambi hanno 6 protoni, ma il carbonio-12 ha 6 neutroni, mentre il carbonio-14 ne ha 8.
Conclusioni
Per calcolare la massa di atomo si è convenuto usare l'unita di misura u.m.a. (unita di massa atomica). Questo evita di fare dei calcoli con numeri che sono estremamente piccoli e scomodi da scrivere o maneggiare.
Domanda
Avete mai fatto qualche esercizio per calcolare la massa atomica di qualche elemento chimico o dei suoi isotopi?
THE END



