
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
07-03-2025 - Chemistry Basics - Orbitals [EN]-[IT]
With this post I would like to give a brief instruction about the topic mentioned in the subject
(code notes: X_88)
Orbitals
Below is a sketch that represents an orbital, where you can see two electrons that are placed in the s1 level
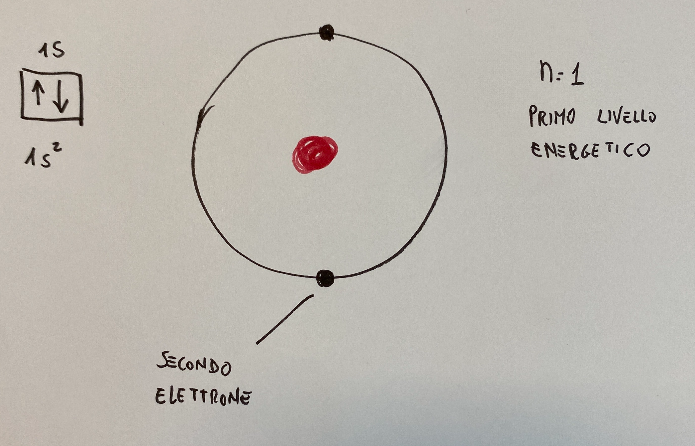
image description
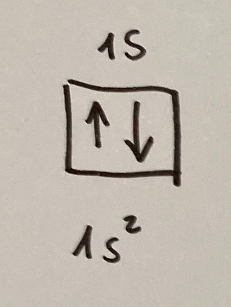
This image represents the electronic configuration of the 1s orbital and expresses the following:
The box with two arrows indicates the 1s orbital
The two arrows point in opposite directions and represent the two electrons with opposite spins. These are the electrons that occupy the 1s orbital
the writing under the 1s^2 box indicates that there are two electrons in the 1s orbital
From this notation, without seeing drawings, we can immediately understand that the 1s orbital is completely occupied.
Around the nucleus of an atom there are orbitals. By definition, orbitals are regions of space around the nucleus of an atom where it is more likely to find electrons.
At this point it is good to remember Wolfgang Pauli who in 1925 formulated what we now call the "Pauli exclusion principle". A fundamental principle in the study of atoms. This principle states that each orbital can contain a maximum of two electrons with opposite spins
To recap
-Orbitals are regions of space around the nucleus.
-Each orbital can have a maximum of two electrons with opposite spins
-Orbitals are described by mathematical functions called wave functions. These wave functions are derived from the Schrödinger equation.
Correlation between orbitals and covalent bond
The theory of covalent bonding and orbitals are closely linked when we enter the field of atomic chemistry. This correlation extends even more clearly when we talk about molecular chemistry.
The correlation between covalent bonding and orbitals is identified in the following things in common:
-When we talk about covalent bonding we mean that atoms share pairs of electrons that are found in the orbitals of the atoms that are part of the bond.
-In covalent bonding the orbitals overlap.
-In covalent bonding the atoms tend to join together to create a more stable electronic configuration
-The Pauli principle that we stated before is important both for the description of orbitals and for the formation of covalent bonding.
Valence Bond Theory
Valence bond theory is a quantum mechanical theory that is extremely important for interpreting the bonds present in molecules. However, it must be noted that this theory does not allow us to interpret the behavior of some substances.
An example is oxygen. Oxygen described by Lewis theory is made up of two atoms linked by a double bond. The remaining electrons are arranged as lone pairs.
Molecular orbitals
The basic idea of this theory is linked to the fact that atomic orbitals can be combined linearly. While in the VB (Valence Bond) theory the linear combination is carried out with the orbitals of the same atom, in the molecular orbital theory the atomic orbitals of two different atoms are combined linearly.
Bond molecular orbital
The bond molecular orbital is made up of the in-phase superposition of the wave functions of the two atoms. This orbital is located at a lower energy level than that associated with the two isolated atoms.
Antibonding molecular orbital
The antibonding molecular orbital is formed by the superposition of the two wave functions in phase opposition. This orbital is located at a higher level than that associated with the two isolated atoms.
Conclusions
Orbitals are regions of space around the nucleus of an atom where the probability of finding electrons is very high. Orbitals are important because:
-They determine the position of electrons
-They are fundamental for the formation of chemical bonds.
-They determine the electronic configuration of an atom.
-They influence the chemical reactivity of atoms and molecules.
Question
Did you study chemistry at school? If YES, was the topic of orbitals easy or difficult to learn?

[ITALIAN]
07-03-2025 - Basi di chimica - Orbitali [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_88)
Orbitali
Qui di seguito uno schizzo che rappresenta un orbitale, dove si vedono due elettroni che si collocano nel livello s1

descrizione immagine

Questa immagine rappresenta la configurazione elettronica dell'orbitale 1s ed esprime quanto segue:
La casella con due frecce indica l'orbitale di tipo 1s
Le due frecce puntano in direzioni opposte e rappresentano i due elettroni con spin opposti. Sono gli elettroni che occupano l'orbitale 1s
la scritta sotto la casella 1s^2 indica che ci sono due elettroni nell'orbitale 1s
Da questa notazione, senza vedere disegni, possiamo subito capire che l'orbitale 1s è completamente occupato.
Attorno al nucleo di un atomo ci sono gli orbitali. Per definizione gli orbitali sono regioni dello spazio attorno al nucleo di un atomo dove è più probabile trovare elettroni.
A questo punto è bene ricordare Wolfgang Pauli che nel 1925 formulò quello che oggi chiamiamo il "principio di esclusione di Pauli". Un principio fondamentale nello studio degli atomi. Questo principio afferma che ogni orbitale può contenere un massimo di due elettroni con spin opposti
Ricapitolando
-Gli orbitali sono regioni dello spazio attorno al nucleo.
-Ogni orbitale può avere al massimo due elettroni con spin opposti
-Gli orbitali sono descritti da funzioni matematiche chiamate funzioni d'onda. Queste funzioni d'onda derivano dall'equazione di Schrödinger.
Correlazione tra orbitali e legame covalente
La teoria del legame covalente e gli orbitali sono strettamente collegati quando entriamo nell'ambito della chimica atomica. Questa correlazione si estende in maniera ancora più evidente quando parliamo di chimica molecolare.
La correlazione tra il legame covalente e gli orbitali si identifica nelle seguenti cose in comune:
-Quando parliamo di legame covalente intendiamo dire che gli atomi condividono coppie di elettroni che si trovano negli orbitali degli atomi che fanno parte del legame.
-Nel legame covalente gli orbitali si sovrappongono.
-Nel legame covalente gli atomi tendono ad unirsi per creare una configurazione elettronica più stabile
-Il principio di Pauli che abbiamo enunciato prima, è importante sia per la descrizione degli orbitali che per la formazione del legame covalente.
Teoria del legame di valenza
La teoria del legame di valenza è una teoria quantomeccanica estremamente importante per interpretare i legami presenti nelle molecole. Bisogna però precisare che tale teoria non consente di interpretare il comportamento di alcune sostanze.
Un esempio è l'ossigeno. L'ossigeno descritto dalla teoria di Lewis è costituito da due atomi legati tramite un doppio legame. I restanti elettroni sono sistemati come coppie solitarie.
Orbitali molecolari
L'idea di base di questa teoria è legata al fatto che gli orbitali atomici possono essere combinati linearmente. Mentre nella teoria VB (Valence Bond = teoria del legame di valenza) la combinazione lineare viene effettuata con gli orbitali dello stesso atomo, nella teoria degli orbitali molecolari si combinano linearmente gli orbitali atomici di due atomi diversi.
Orbitale molecolare legante
L'orbitale molecolare legante è costituito dalla sovrapposizione in fase delle funzioni d'onda dei due atomi. Questo orbitale si colloca ad un livello energetico più basso di quello associato ai due atomi isolati.
Orbitale molecolare antilegante
L'orbitale molecolare antilegante è costituito dalla sovrapposizione in opposizione di fase delle due funzioni d'onda. Questo orbitale si colloca ad un livello più alto di quello associato ai due atomi isolati.
Conclusioni
Gli orbitali sono regioni dello spazio attorno al nucleo di un atomo dove la probabilità di trovare elettroni è molto elevata. Gli orbitali sono importanti perché:
-Determinano la posizione degli elettroni
-Sono fondamentali per la formazione dei legami chimici.
-Essi determinano la configurazione elettronica di un atomo.
-Influiscono sulla reattività chimica degli atomi e delle molecole.
Domanda
Avete studiato chimica a scuola? Se SI, l'argomento degli orbitali è stato facile o difficile da apprendere?
THE END

