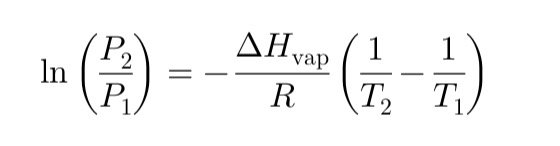~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH

27-03-2025 - Chemistry Basics - Vapor Pressure [EN]-[IT]
With this post I would like to give a brief instruction about the topic mentioned in the subject
(code notes: X_65)
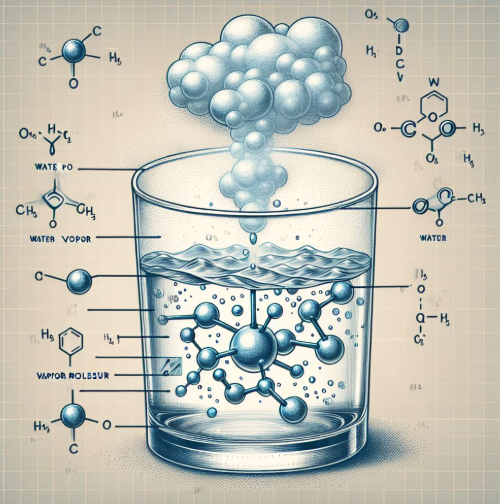
Image created with artificial intelligence using Microsoft Copilot
Vapor Pressure
In the chemical field, when we talk about vapor pressure we refer to the pressure exerted by the vapor of a substance when it is in equilibrium with its liquid phase.
We can also say that it is the pressure at which the vapor of a substance coexists with its liquid in a closed system.
Here is its mathematical expression:
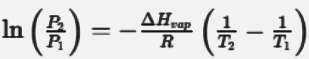
Where.
P1 and P2 = vapor pressures at two different temperatures relative to T1 and T2
ΔHvap = enthalpy of vaporization
R = universal gas constant
We can deduce that the vapor pressure depends on the temperature. It increases with the increase in temperature. This phenomenon occurs because the molecules have more energy to evaporate.
Enthalpy of vaporization
The enthalpy of vaporization is also known as heat of vaporization. It is defined as the energy needed to transform a mole of a substance from its liquid state to its gaseous state taking into account that the pressure is constant. It should be noted that the process occurs without temperature variation.
We can also say that the enthalpy of vaporization is the energy required to break the intermolecular forces that hold the molecules together in the liquid. This process is what will then take the substance from the liquid to the gaseous state.
The enthalpy of vaporization is usually expressed in kilojoules per mole (kJ/mol).
The enthalpy of vaporization and water
If we consider water, we all know that the boiling point is 100°. We can therefore say that the enthalpy of vaporization at 100°C corresponds to just under 41 kJ/mol. Going back to what was written before, we can say that about 41 kJ of energy are needed to vaporize a mole of water at 100° C.
Vapor pressure and the change in Gibbs free energy
There is a link between the vapor pressure and the change in Gibbs free energy. This link is fundamental to understanding the equilibrium between the liquid and gaseous phases.
The Gibbs free energy change (ΔG) for the vaporization process is related to the vapor pressure through the following mathematical formula:
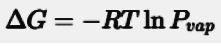
Where:
ΔG = Gibbs free energy
R = universal gas constant (8.314 J/(mol K)
T = the absolute temperature (K)
Pvap = the vapor pressure
From the formula shown above we can say the following.
The Gibbs free energy change for vaporization is directly proportional to the natural logarithm of the vapor pressure
Equation of Clausius-Clapeyron
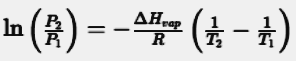
The Clausius-Clapeyron equation describes the relationship between the vapor pressure of a substance and its temperature. This relationship is used to understand how vapor pressure changes with temperature. It is also used to calculate the enthalpy of vaporization of a substance.
Conclusions
Vapor pressure is a concept that becomes very important when studying the phenomena of boiling and condensation. In simple terms, we can define the vapor pressure of a substance as the pressure exerted by its vapor when it is in equilibrium with its liquid phase.
This particular formula assumes that the enthalpy of vaporization is constant for a relatively small temperature range and that the vapor behaves as an ideal gas. However, despite the strain of these simplifications, this equation can be used with a good approximation for many real systems.
Question
Let's imagine that we have a glass of water left on the table and we are not going to heat it. The water in the glass will slowly start to evaporate. This happens because the water molecules on the surface of the liquid have enough energy to escape the liquid phase. The vapor pressure of water is the pressure exerted by these water molecules that have passed into the gas phase. Did you know that in the case of water evaporating from an unheated glass the physical phenomenon of vapor pressure was involved?

ITALIAN

27-03-2025 - Basi di chimica - Tensione di vapore [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_65)

Immagine creata con l'intelligenza artificiale usando Microsoft Copilot
Tensione di vapore
In ambito chimico quando parliamo di tensione vapore ci riferiamo alla pressione esercitata dal vapore di una sostanza quando questa è in equilibrio con la sua fase liquida.
Possiamo anche dire che è la pressione alla quale il vapore di una sostanza coesiste con il suo liquido in un sistema chiuso.
Qui di seguito la sua espressione matematica:
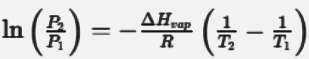
Dove.
P1 e P2 = tensioni di vapore a due temperature diverse relative a T1 e T2
ΔHvap = entalpia di vaporizzazione
R = costante universale dei gas
Possiamo dedurre che la tensione vapore dipende dalla temperatura. Essa aumenta con l'aumento della temperatura. Questo fenomeno avviene perché le molecole hanno più energia per evaporare.
Entalpia di vaporizzazione
L'entalpia di vaporizzazione viene è nota anche come calore di vaporizzazione. Essa viene definita come l'energia necessaria per trasformare una mole di una sostanza dal suo stato liquido al suo stato gassoso tenendo conto che la pressione è costante. Si precisa che il processo avviene senza variazione di temperatura.
Possiamo anche dire che l'entalpia di vaporizzazione è l'energia richiesta per rompere le forze intermolecolari che tengono insieme le molecole nel liquido. Questo processo è quello che porterà poi la sostanza dallo stato liquido a quello gassoso.
L'entalpia di vaporizzazione è solitamente espressa in kilojoule per mole (kJ/mol).
L'entalpia di vaporizzazione e l'acqua
Se consideriamo l'acqua, tutti sappiamo che il punto di ebollizione è a 100°. Possiamo quindi dire che l'entalpia di vaporizzazione a 100°C corrisponde a poco meno di 41 kJ/mol. Riprendendo quanto è stato scritto prima, possiamo dire che sono necessari circa 41 kJ di energia per vaporizzare una mole di acqua a 100° C.
Tensione di vapore e la variazione di energia libera di Gibbs
Tra la tensione di vapore e la variazione di energia libera di Gibbs esiste un legame. Questo legame è fondamentale per comprendere l'equilibrio tra le fasi liquida e gassosa.
La variazione di energia libera di Gibbs (ΔG) per il processo di vaporizzazione è legata alla tensione di vapore attraverso la seguente formula matematica:
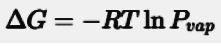
Dove:
ΔG = energia libera di Gibbs
R = costante universale dei gas (8.314 J/(mol·K)
T = la temperatura assoluta (K)
Pvap = la tensione di vapore
Dalla formula mostrata qui sopra possiamo dire quanto segue.
La variazione di energia libera di Gibbs per la vaporizzazione è direttamente proporzionale al logaritmo naturale della tensione di vapore
Equazione di Clausius-Clapeyron
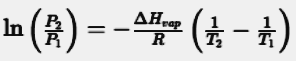
L'equazione di Clausius-Clapeyron descrive la relazione tra la pressione di vapore di una sostanza e la temperatura. Si usa questa relazione per capire come la pressione vapore cambia con la temperatura. Essa viene anche usata per calcolare l'entalpia di vaporizzazione di una sostanza.
Conclusioni
La tensione vapore è un concetto che acquista molta importanza quando si studiano i fenomeni dell'ebollizione e della condensazione. In parole semplici possiamo definire la tensione di vapore di una sostanza come la pressione esercitata dal suo vapore quando è in equilibrio con la sua fase liquida.
Questa particolare formula suppone che l'entalpia di vaporizzazione sia costante per un intervallo di temperatura relativamente piccolo e che i il vapore si comporti come un gas ideale. Tuttavia, nonostante la forzatura di queste semplificazioni, questa equazione si può usare con una buona approssimazione per molti sistemi reali.
Domanda
Pensiamo di avere un bicchiere d'acqua lasciato sul tavolo e non andremo a riscaldarlo. L'acqua nel bicchiere inizierà lentamente a evaporare. Questo avviene perché le molecole d'acqua sulla superficie del liquido hanno abbastanza energia per sfuggire alla fase liquida. La tensione di vapore dell'acqua è la pressione esercitata da queste molecole d'acqua che sono passate alla fase gassosa. Lo sapevate che in nel caso dell'acqua che evapora da un bicchiere non riscaldato era coinvolto il fenomeno fisico della tensione vapore?
THE END