
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
24-02-2025 - Chemistry Basics - Wolfgang Pauli [EN]-[IT]
With this post I would like to give a brief instruction on the topic mentioned in the subject
(code notes: X_93)
Wolfgang Pauli

AI generated image, COPILOT software used
Wolfgang Pauli was an Austrian physicist naturalized Swiss.
He made an important contribution in the field of quantum mechanics.
In 1925 Pauli formulated the "Pauli exclusion principle".
The Pauli exclusion principle is a principle of quantum mechanics that states the following:
-two identical fermions cannot simultaneously occupy the same quantum state.
According to the Pauli exclusion principle, an orbital can contain a maximum of two electrons, provided they have opposite spin
Electronic configuration
The electrons go to occupy the available orbitals with the lowest energy in order to minimize the energy of the atom. This happens following two rules.
-The Pauli exclusion principle
-The principle of maximum multiplicity (Hund's rule)
The three quantum numbers (n,l,m) allow us to define the orbital and its energy, but they do not yet define the single electron because they do not take into account the SPIN of the electron.
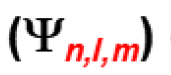
SPIN of the electron
The electron rotates on itself creating a magnetic field in 2 directions:
-1-
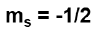
-2-
Now let's go back to the Pauli exclusion principle describing it in more detail also including the correct descriptions of certain concepts
...let's start
the Pauli exclusion principle
Each orbital...
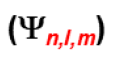
...can contain only 2 electrons and one electron will have...
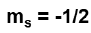
while the other
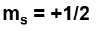
That is, electrons paired in the same orbital must have opposite spin. In this case the resulting magnetic field is equal to zero. This corresponds to the state of least magnetic repulsion.
Example
He (helium) atom

1s orbital
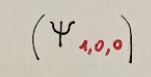
2e paired with opposite SPIN
the first
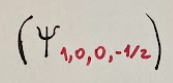
and the second
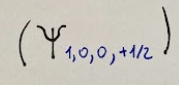
Conclusions
The Pauli exclusion principle is essential to understanding the structure of atoms and the arrangement of electrons in orbitals.
Question
Have you heard of Wolfgang Pauli? Did you know that his principle is fundamental to understanding chemistry as we know it today?

[ITALIAN]
24-02-2025 - Basi di chimica - Wolfgang Pauli [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_93)
Wolfgang Pauli

immagine generata con IA, software usato COPILOT
Wolfgang Pauli è stato un fisico austriaco naturalizzato svizzero.
Diede un importante contributo nel settore della meccanica quantistica.
Nel 1925 Pauli formulò il "Principio di esclusione di Pauli".
Il principio di esclusione di Pauli è un principio della meccanica quantistica che afferma quanto segue:
-due fermioni identici non possono occupare simultaneamente lo stesso stato quantico.
Secondo il principio di esclusione di Pauli, un orbitale può contenere al massimo due elettroni, purché di spin opposto
Configurazione elettronica
Gli elettroni vanno ad occupare gli orbitali disponibili a più bassa energia in modo da rendere minima l'energia dell'atomo. Questo avviene seguendo due regole.
-Il principio di esclusione di Pauli
-Il principio di massima molteplicità (regola di Hund)
I tre numeri quantici (n,l,m) consentono di definire l'orbitale e la sua energia, ma non definiscono ancora il singolo elettrone perché non tengono conto dello SPIN dell'elettrone.
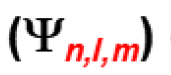
SPIN dell'elettrone
L'elettrone ruota su se stesso creando un campo magnetico in 2 direzioni:
-1-
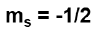
-2-
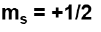
Ora andiamo a riprendere il principio di esclusione di Pauli descrivendolo più nel dettaglio comprendendo anche le descrizione corrette di certi concetti
...partiamo
il principio di esclusione di Pauli
Ogni orbitale...
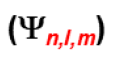
...può contenere solo 2 elettroni ed un elettrone avrà...
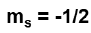
mentre l'altro
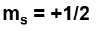
Ovvero, gli elettroni accoppiati nello stesso orbitale devono avere spin opposto. In questo caso il campo magnetico risultante è uguale a zero. Questo corrisponde allo stato di minore repulsione magnetica.
Esempio
Atomo di He (elio)

Orbitale 1s
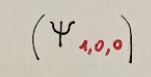
2e accoppiati con SPIN opposto
il pirmo
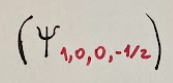
ed il secondo
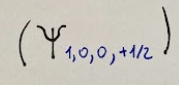
Conclusioni
Il principio di esclusione di Pauli è essenziale per comprendere la struttura degli atomi e la disposizione degli elettroni negli orbitali.
Domanda
Avevate già sentito parlare di Wolfgang Pauli? Lo sapevate che il suo principio è fondamentale per comprendere la chimica per come la conosciamo oggi?
THE END