
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
11-02-2025 - Chemistry Basics - The Bohr Model [EN]-[IT]
With this post I would like to give a brief instruction on the topic mentioned in the subject
(code notes: X_95)
The Bohr Model
The Danish scientist Niels Bohr was the first to try to give an explanation of the stability of atoms.
The hypotheses that Bohr formulated were the following:
-The electron can move around the nucleus according to circular orbits (actually elliptical) to which corresponds a well-defined energy state (stationary orbits)
-When an atom is in a stationary state it does not emit energy, this state is also called fundamental. In order to do so, an electron must be brought to a higher energy state. At this point the atom becomes unstable, the electron returns to the initial energy state emitting a well-defined amount of energy. This energy is called a quantum of radioactivity.
-Stationary states have a quantized value of angular momentum.
Here is the expression for the energy on the stationary orbit
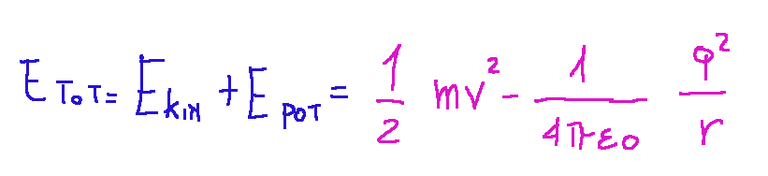
Limitations of the Bohr model
The Bohr atomic model allows us to successfully interpret the atomic spectrum of hydrogen (H), which is monoelectronic, but it is not able to interpret polyelectronic atomic spectra.
The difference between a monoelectronic and a polyelectronic atomic spectrum lies in the number of electrons present in the atom and in the interactions between these electrons. A single-electron atomic spectrum refers to the emission or absorption of light by an atom that has only one electron. A multi-electron atomic spectrum refers to atoms with more than one electron. These atoms have much more complex spectra due to the interactions between the different electrons.
So in Bohr's atomic model, something was wrong, that is, it worked for some cases, but not for others.
At this point comes Heisenberg's idea
The Heisenberg uncertainty principle
the principle states that it is not possible to know simultaneously and with absolute precision both the position (x) and the momentum (p) of a particle.
The principle is expressed by the following inequality:
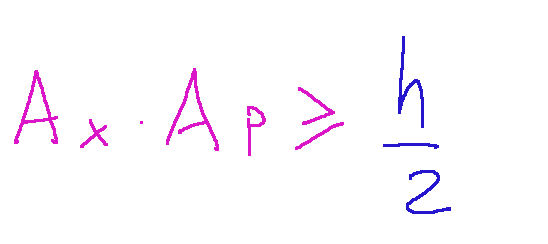
Where:
Δ𝑥 is the uncertainty in the measurement of the position
Δ𝑝 is the uncertainty in the measurement of the momentum
ℏ is the reduced Planck constant, equal to h/2𝜋
Trying to summarize further, we can say that the Heisenberg uncertainty principle shows us that if we try to measure the position of a particle with great precision, the uncertainty in the measurement of its momentum increases, and vice versa.
The formula for calculating the uncertainty of the position is as follows:
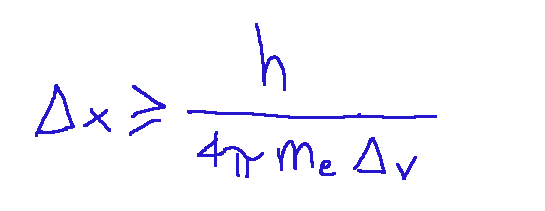
Where:
Δp=meΔv is the uncertainty in the momentum
h=6.626×10^−34 J s is the Planck constant
me =9.11×10^−31 kg is the mass of the electron
Δv=1 m/s is the uncertainty in the velocity
Conclusions
Niels Bohr is remembered for his fundamental contribution to atomic physics and quantum mechanics. Among his discoveries is the well-known Bohr atomic model, proposed in 1913. This model described the atom as a positively charged nucleus surrounded by electrons that orbit in specific and quantized orbits.
The Heisenberg uncertainty principle adjusts the theory formulated by Bohr. With this principle it is stated that it is impossible to determine simultaneously and with absolute precision the velocity and position of an electron
Question
Do you remember studying the Bohr atomic model in school? Or do you remember having some lessons about the famous Heisenberg uncertainty principle?

[ITALIAN]
11-02-2025 - Basi di chimica - Il modello di Bohr [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_95)
Il modello di Bohr
Lo scienziato danese Niels Bohr è stato il primo a cercare di dare una spiegazione della stabilità degli atomi.
Le ipotesi che formulo Bohr furono le seguenti:
-L'elettrone può muoversi intorno al nucleo secondo orbite circolari (in realtà ellittiche) a cui corrisponde un ben definito stato energetico (orbite stazionarie)
-Quando un atomo si trova in uno stato stazionario non emette energia, questo stato è detto anche fondamentale. Per poterlo fare, un elettrone deve essere portato ad uno stato di energia superiore. A questo punto l'atomo diventa instabile, l'elettrone ritorna nello stato energetico iniziale emettendo una ben definita quantità di energia. Questa energia viene chiamata quanto di radioazione.
-Gli stati stazionari hanno un valore quantizzato del momento angolare.
Qui di seguito l'espressione dell'energia sull'orbita stazionaria
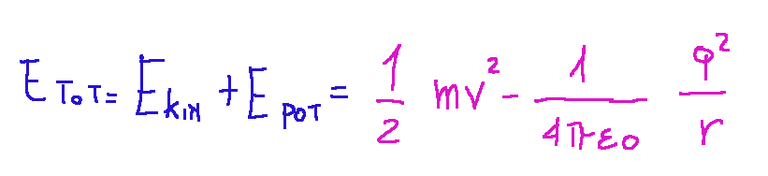
Limiti del modello di Bohr
Il modello atomico di Bohr permette di interpretare con successo lo spettro atomico dell'idrogeno (H), che è monoelettronico, ma non è in grado di interpretare spettri atomici polielettronici.
La differenza tra uno spettro atomico monoelettronico e uno polielettronico risiede nel numero di elettroni presenti nell'atomo e nelle interazioni tra questi elettroni. Uno spettro atomico monoelettronico si riferisce all'emissione o all'assorbimento di luce da parte di un atomo che possiede un solo elettrone. Uno spettro atomico polielettronico riguarda atomi con più di un elettrone. Questi atomi hanno spettro molto più complessi a causa delle interazioni tra i diversi elettroni.
Quindi nel modello atomico di Bohr, qualcosa non funzionava, cioè andava bene per alcuni casi, ma per altri no.
A questo punto arriva l'idea di Heisenberg
Il principio di indeterminazione di Heisemberg
il principio afferma che non è possibile conoscere contemporaneamente e con precisione assoluta sia la posizione (x) che la quantità di moto (p) di una particella.
Il principio è espresso dalla seguente disuguaglianza:
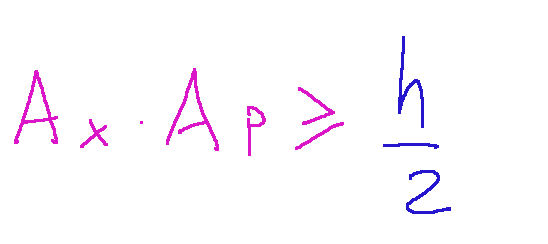
Dove:
Δ𝑥 è l'incertezza nella misura della posizione
Δ𝑝 è l'incertezza nella misura della quantità di moto
ℏ è la costante di Planck ridotta, pari a h/2𝜋
Cercando di sintetizzare ancora possiamo dire che il principio di indeterminazione di Heisemberg ci dimostra che se cerchiamo di misurare la posizione di una particella con grande precisione, l'incertezza nella misura della sua quantità di moto aumenta, e viceversa.
La formula del calcolo dell'incertezza della posizione è la seguente:
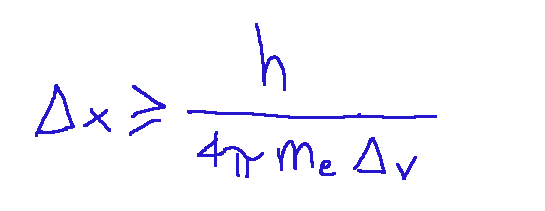
Dove:
Δp=meΔv è l'incertezza nella quantità di moto
h=6.626×10^−34 J·s è la costante di Planck
me =9.11×10^−31 kg è la massa dell'elettrone
Δv=1 m/s è l'incertezza sulla velocità
Conclusioni
Niels Bohr è ricordato per il suo contributo fondamentale alla fisica atomica e alla meccanica quantistica. Tra le sue scoperte è ben noto il modello atomico di Bohr, proposto nel 1913. Questo modello descriveva l'atomo come un nucleo carico positivamente circondato da elettroni che orbitano in orbite specifiche e quantizzate.
Il principio di indeterminazione di Heisemberg aggiusta la teoria formulata da Bohr. Con questo principio si afferma che è impossibile determinare simultaneamente e con precisione assoluta velocità e posizione di un elettrone
Domanda
Ricordate di aver studiato a scuola il modello atomico di Bohr? Oppure ricordate di aver fatto qualche lezione a riguardo del famoso principio di indeterminazione di Heisemberg?
THE END
