
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH

27-03-2025 - Chemistry Basics - Physical Equilibria [EN]-[IT]
With this post I would like to give a brief instruction on the topic mentioned in the subject
(code notes: X_64)
Physical Equilibria

image created with artificial intelligence, Microsoft Copilot software*
Description
In the chemical field, physical equilibria refer to situations in which two or more phases of a substance are in equilibrium with each other.
To better clarify the concept we can say that a physical equilibrium of a substance occurs when the relative quantities of the different phases remain constant over time, even if the molecules can pass from one phase to another.
Liquid-vapor equilibrium
In the previous article I mentioned an example with a glass of water, we can use that example again to explain physical equilibrium. Let's think of a glass with water inside and a cap that prevents the water and vapor from escaping. It will happen that the water (the liquid state of the substance) and the water vapor above it reach an equilibrium in which the evaporation rate of the water is equal to the condensation rate of the vapor.
Solid-liquid equilibrium
Another example that we can cite is always that of the glass, but not with liquid, but with water at 0°, therefore with a solid, namely ice.
At a temperature of 0° ice and water can be in equilibrium together. In this case it will happen that the ice melts at the same speed with which the water freezes.
From these two examples we now better understand the sentence that describes a physical equilibrium, that is, that the physical equilibrium of a substance occurs when the relative quantities of the different phases remain constant while the molecules pass from one phase to another.
Sublimation
Sublimation is the process by which a substance passes directly from the solid phase to the gaseous phase, completely skipping the liquid phase.
In general, it is possible to identify an equilibrium relationship of the same type for each of the following equilibrium processes: Liquid-Gas, Solid-Gas, Solid-Liquid.
Examples below following the chemical formulas and highlighting the states:
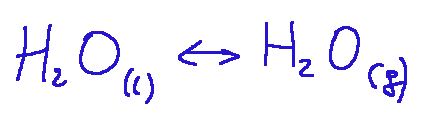
Liquid-Gas (evaporation)
Solid-Gas (sublimation)

Solid-Liquid (fusion)
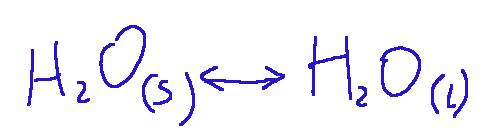
The first process identifies the evaporation of a liquid or the condensation of its vapor. The second process identifies the sublimation of
a solid (in the case of water, the process that leads directly from the gas phase to the solid phase is called frosting). The third process
identifies the fusion of a solid or the solidification of the corresponding liquid.
While for the first two processes the vapor pressure (the same term is also used for the sublimation process) depends exponentially
on the temperature through the Clausius-Clapeyron equation, in the third case (fusion/solidification) the relationship between equilibrium pressure and
temperature is substantially linear. In the case of water, it is possible to report the three equilibrium curves (L-G, S-G and S-L) on the same graph
which is called the water state diagram. In practice, the three equilibrium curves divide the plane (P,T) into three regions, one for each
phase.
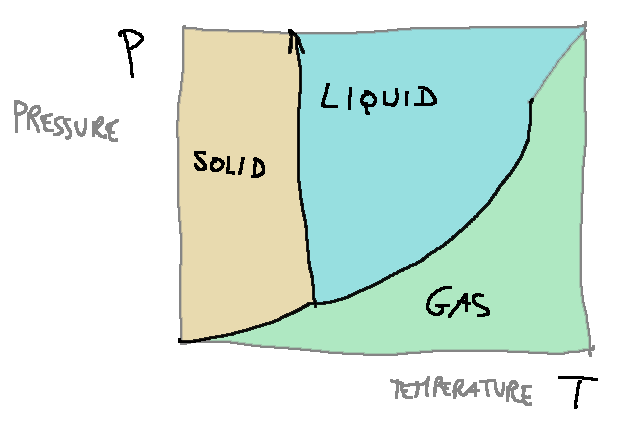
The three curves intersect at a point called the “triple point” where all three phases coexist (for water the triple point temperature is 0.0098 °C while the corresponding pressure is 6.0*10-3 atm).
Conclusions
In conclusion we can say that physical equilibria in chemistry refer to situations in which the system reaches a condition of dynamic equilibrium between two or more physical states or processes.
Question
The equilibrium between liquid and gaseous phases is the basis of the operation of refrigerators and air conditioners. Did you know that in the operation of heat pumps the phase changes of refrigerants are exploited to absorb or release heat?

ITALIAN

27-03-2025 - Basi di chimica - Equilibri fisici [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_64)
Equilibri fisici

immagine creata con l'intelligenza artificiale, software Microsoft Copilot*
Descrizione
In ambito chimico gli equilibri fisici si riferiscono a situazioni in cui due o più fasi di una sostanza sono in equilibrio tra loro.
Per chiarire meglio il concetto possiamo dire che un equilibrio fisico di una sostanza si ha quando le quantità relative delle diverse fasi rimangono costanti nel tempo, anche se le molecole possono passare da una fase all'altra.
Equilibrio liquido vapore
Nell'articolo precedente avevo menzionato un esempio con un bicchiere d'acqua, possiamo riprendere quell'esempio per spiegare l'equilibrio fisico. Pensiamo appunto ad un bicchiere con al suo interno dell'acqua e con un tappo che impedisce la fuoriuscita di acqua e vapore. Succederà che l'acqua (lo stato liquido della sostanza) e il vapore acqueo sopra di essa raggiungono un equilibrio in cui la velocità di evaporazione dell'acqua è uguale alla velocità di condensazione del vapore.
Equilibrio solido-liquido
Un altro esempio che possiamo citare è sempre quello del bicchiere, ma non con del liquido, ma con dell'acqua a 0°, quindi con un solido, ovvero il ghiaccio.
Alla temperatura di 0° il ghiaccio e l'acqua possono stare insieme in equilibrio. In questo caso si verificherà che il ghiaccio si scioglie alla stessa velocità con cui l'acqua si congela.
Da questi due esempi capiamo ora meglio la frase che descrive un equilibrio fisico, cioè che l'equilibrio fisico di una sostanza si ha quando le quantità relative delle diverse fasi rimangono costanti mentre le molecole passano da una fase all'altra.
Sublimazione
La sublimazione è il processo attraverso il quale una sostanza passa direttamente dalla fase solida alla fase gassosa saltando completamente la fase liquida.
In generale è possibile individuare una relazione di equilibrio dello stesso tipo per ciascuno dei seguenti processi di equilibrio: Liquido-Gas, Solido-Gas, Solido-Liquido.
Esempi qui sotto riportati seguendo le formule chimiche ed evidenziandone gli stati:
Liquido-Gas (evaporazione)

Solido-Gas (sublimazione)

Solido-Liquido (fusione)
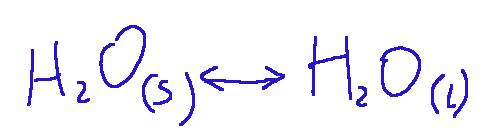
Il primo processo identifica l’evaporazione di un liquido o la condensazione del suo vapore. Il secondo processo identifica la sublimazione di
un solido (nel caso dell’acqua il processo che dalla fase gas porta direttamente alla fase solida si chiama brinamento). Il terzo processo
identifica la fusione di un solido oppure la solidificazione del liquido corrispondente.
Mentre per i primi due processi la tensione di vapore (si usa lo stesso termine anche per il processo di sublimazione) dipende esponenzialmente
dalla temperatura tramite l’equazione di Clausius-Clapeyron, nel terzo caso (fusione/solidificazione) la relazione tra pressione di equilibrio e
temperatura è sostanzialmente lineare. Nel caso dell’acqua è possibile riportare le tre curve di equilibrio (L-G, S-G e S-L) su uno stesso grafico
che prende il nome di diagramma di stato dell’acqua. In pratica le tre curve di equilibrio dividono il piano (P,T) in tre regioni, una per ciascuna
fase.

Le tre curve si intersecano in un punto chiamato “punto triplo” in cui coesistono tutte e tre le fasi (per l’acqua la temperatura di punto triplo è di 0.0098 °C mentre la pressione corrispondente è di 6.0*10-3 atm).
Conclusioni
In conclusione possiamo dire gli equilibri fisici in chimica si riferiscono a situazioni in cui il sistema raggiunge una condizione di bilanciamento dinamico tra due o più stati fisici o processi.
Domanda
L'equilibrio tra fasi liquide e gassose è alla base del funzionamento di frigoriferi e condizionatori. Lo sapevate che nel funzionamento delle pompe di calore si sfruttano i cambiamenti di fase dei refrigeranti per assorbire o rilasciare calore?
THE END
