
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH

02-04-2025 - Chemistry Basics - Chemical Equilibrium (part 2) [EN]-[IT]
With this post I would like to give a brief instruction about the topic mentioned in the subject
(code notes: X_58)
***Chemical Equilibrium (part 2) ***

image created with artificial intelligence, the software used is Microsoft Copilot
Introduction
As regards chemical equilibrium we talked about it in the post previous to this one. In summary we can say the following.
Chemical equilibrium is a state in which, in a reversible reaction, the rate of the forward reaction (from reactants to products) is equal to the rate of the reverse reaction (from products to reactants).
Pressure on equilibrium
As far as chemical equilibrium is concerned, we can say that pressure can be influential. Let us specify that pressure affects chemical equilibrium only in reactions involving gases. Let us try to take the following reaction as an example.
Below is the reaction for the synthesis of ammonia (NH₃)
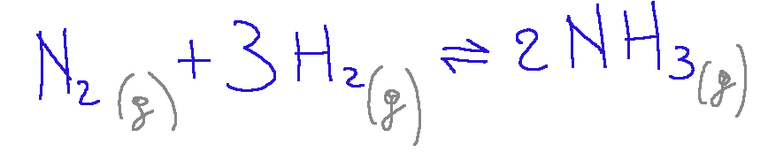
From this reaction we see that on the left there are four gas molecules while on the right we have two gas molecules.
In such a reaction, if the pressure is increased, the equilibrium shifts to the right, generating more product.
If, on the other hand, the pressure is decreased, the equilibrium shifts to the left, that is, towards the four molecules.
Le Chatelier's Principle

image created with artificial intelligence, the software used is Microsoft Copilot
Henri Louis Le Châtelier was a French chemist and metallurgist. He was born in 1850 and died in 1936 and is known for having enunciated in 1884 the law of equilibrium also known as Le Châtelier's principle.
His principle states that when a system is perturbed at equilibrium, the system responds in such a way as to minimize the imposed perturbation.
The ammonia synthesis reaction occurs with a reduction in the number of moles (Δn=-2). If the pressure is increased at constant T (V decreases) the system "responds" in a way that opposes the increase in pressure, that is, by decreasing it. The only way to reduce the pressure is to make N2 and H2 react to produce NH3. In fact, let's keep in mind that the total pressure is proportional to the total moles through the gas equation of state. So if the total moles decrease, the pressure also decreases. For this reaction, an increase in pressure shifts the equilibrium towards the products, a decrease shifts the equilibrium towards the reagents.
Effect of temperature on equilibrium
When the temperature of a system in equilibrium is changed, the equilibrium shifts to compensate for this change and minimize its effect. A behavior of the system similar to that described above regarding pressure.
-Exothermic reactions - If the temperature increases, the equilibrium shifts towards the reagents, since the additional heat is treated as a "product".
-Endothermic reactions - If the temperature increases, the equilibrium shifts toward the products, as the system absorbs heat as part of the reaction.
Van't Hoff equation
It is a relationship that allows you to calculate the equilibrium constant at a certain temperature given its value at a given temperature and the ΔH of the reaction.
The van't Hoff equation is used in chemistry to describe how the equilibrium constant (𝐾) of a chemical reaction varies with temperature.
Below I report the equation:
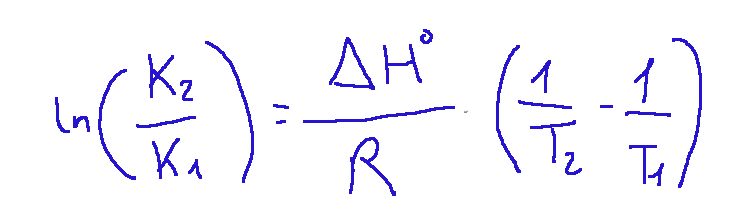
Where:
K1 and K2 = equilibrium constant at two different temperatures T1 and T2
Δ𝐻∘ = the standard enthalpy of the reaction
𝑅 = universal gas constant (8.314 J mol^−1 K^−1).
With the van’t Hoff equation we can predict the behavior of the chemical equilibrium, calculate the standard enthalpy of the reaction and evaluate the optimal conditions for the reaction.
Conclusions
Chemical balances are essential in industry to reduce costs and optimize production.
The most studied and used chemical balances in industry are: ammonia synthesis balance, esterification balance (perfume sector), hydrogenation balance (food sector), oxidation-reduction balance (battery sector)
Question
Batteries, in general, exploit oxidation-reduction chemical reactions that represent a dynamic balance between the conversion of chemical energy and electrical energy. Did you know that this chemical balance is the basis of how batteries work?

ITALIAN

02-04-2025 - Basi di chimica - Equilibrio chimico (parte 2) [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_58)
***Equilibrio chimico (parte 2) ***

immagine creata con l’intelligenza artificiale, il software usato è Microsoft Copilot
Introduzione
Per quanto riguarda l’equilibrio chimico ne abbiamo parlato nel post precedente a questo. In sintesi possiamo dire quanto segue.
L’equilibrio chimico è uno stato in cui, in una reazione reversibile, la velocità della reazione diretta (da reagenti a prodotti) è uguale alla velocità della reazione inversa (da prodotti a reagenti).
La pressione sull’equilibrio
Per quanto riguarda l’equilibrio chimico, possiamo dire che la pressione può essere influente. Precisiamo che la pressione influisce sull’equilibrio chimico solo sulle reazioni in cui sono coinvolti i gas.proviamo a prendere come esempio la seguente reazione.
Qui di seguito è riportata la reazione di sintesi dell’ammoniaca (NH₃)
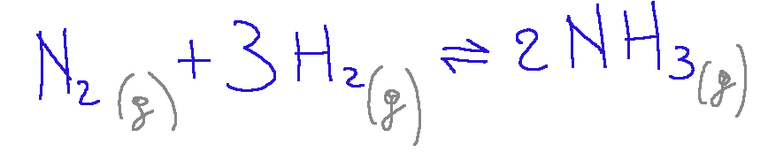
Da questa reazione vediamo che a sinistra ci sono quattro molecole gassose mentre a destra abbiamo due molecole gassose.
In una reazione del genere, se si aumenta la pressione, l'equilibrio si sposta verso destra, generando più prodotto.
Se invece la pressione diminuisce, l’equilibrio si sposta verso sinistra, cioè verso le quattro molecole.
Principio di Le Chatelier

immagine creata con l’intelligenza artificiale, il software usato è Microsoft Copilot
Henri Louis Le Châtelier è stato un chimico e metallurgista francese. Nacque nel 1850 e morì nel 1936 ed è noto per aver enunciato nel 1884 la legge sull'equilibrio conosciuta anche come principio di Le Châtelier.
Il suo principio dice che quando si perturba un sistema all’equilibrio, il sistema risponde in maniera tale da minimizzare la perturbazione imposta.
La reazione di sintesi dell’ammoniaca avviene con riduzione del numero di moli (Δn=-2). Se si aumenta la pressione a T costante (V diminuisce) il sistema «risponde» in modo da opporsi all’aumento di pressione, e cioè facendola diminuire. L’unico modo per ridurre la pressione è far reagire N2 e H2 producendo NH3. Teniamo presente, infatti, che la pressione totale è proporzionale alle moli totali tramite l’equazione di stato dei gas. Quindi se le moli totali diminuiscono anche la pressione diminuisce. Per questa reazione, un aumento di pressione sposta l’equilibrio verso i prodotti, una diminuzione sposta l’equilibrio verso i reagenti.
Effetto della temperatura sull’equilibrio
Quando la temperatura di un sistema in equilibrio viene modificata, l'equilibrio si sposta per compensare questo cambiamento e minimizzarne l'effetto. Un comportamento del sistema simile a quello che abbiamo descritto prima a riguardo della pressione.
-Reazioni esotermiche - Se la temperatura aumenta, l'equilibrio si sposta verso i reagenti, poiché il calore aggiuntivo viene trattato come un "prodotto".
-Reazioni endotermiche - Se la temperatura aumenta, l'equilibrio si sposta verso i prodotti, in quanto il sistema assorbe il calore come parte della reazione.
Equazione di van’t Hoff
È una relazione che permette di calcolare la costante di equilibrio ad una certa temperatura noto il suo valore ad una temperatura assegnata e il ΔH di reazione.
L'equazione di van't Hoff è utilizzata in chimica per descrivere come la costante di equilibrio (𝐾) di una reazione chimica varia con la temperatura.
Qui di seguito riporto l'equazione:
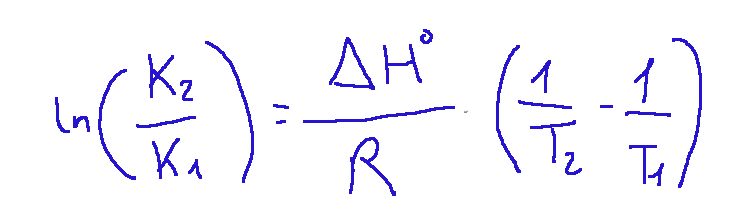
Dove:
K1 e K2 = costante di equilibrio a due temperature differenti T1 e T2
Δ𝐻∘ = l'entalpia standard della reazione
𝑅 =costante universale dei gas (8,314 J mol^−1 K^−1).
Con l'quazione di van’t Hoff possiamo prevedere il comportamento dell'equilibrio chimico, calcolare l'entalpia standard della reazione e valutare le condizioni ottimali per la reazione.
Conclusioni
Gli equilibri chimici sono fondamentali nell'industria per ridurre i costi e ottimizzare la produzione.
Gli equilibri chimici più studiati e utilizzati nell'industria sono: l'equilibrio nella sintesi dell'ammoniaca, l'equilibrio di esterificazione (settore profumi), l'equilibrio di idrogenazione (settore alimentare), l'equilibrio di ossidoriduzione (settore batterie)
Domanda
Le batterie, in generale, sfruttano reazioni chimiche di ossidoriduzione che rappresentano un equilibrio dinamico tra la conversione di energia chimica ed energia elettrica. Lo sapevate che questo equilibrio chimico è alla base del funzionamento delle batterie?
THE END