
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH

25-08-2025-Materials Technologies - Electronic Configuration [EN]-[IT]
With this post, I would like to provide a brief introduction to the topic in question.
(lesson/article code: QE_02)

image created with artificial intelligence, the software used is Microsoft Copilot
Introduction
When we're in the field of materials technologies, when we talk about electronic configuration, we're referring to how electrons are distributed in the different energy levels and sublevels around the nucleus of an atom.
Here are some technical aspects regarding electronic configuration.
Diagonal Rule
The diagonal rule, also known as the Madelung rule, is a rule also used in chemistry and atomic physics to determine the order in which electron orbitals are filled.
Note: An electron orbital is a region of space around the nucleus where an electron is most likely to be found. I take this opportunity to reiterate that the electron inside the orbital does not follow a fixed trajectory.
Below is an example of the Madelung rule.
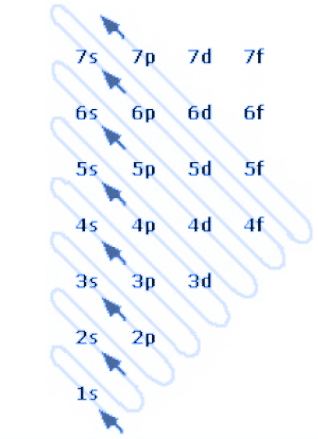
In this image, we see that numbers form rows, and these represent the atomic orbitals. The abbreviations s, p, d, and f are the abbreviations for the various orbitals (they can be of type s, p, d, or f), flanked by a number that is the principal quantum number.
The other thing we notice are the diagonal arrows. These indicate the order in which the electrons fill the various orbitals.
And now comes the more technical part of the diagonal rule (or Madelung rule).
The basic principle of this rule is that in this scheme, atoms are arranged in orbitals according to the principle of minimum energy: first they occupy the lowest energy levels, then the highest energy levels. The filling sequence depends on the sum n + 1, or principal quantum number + secondary quantum number.
I admit that without understanding the basics of how an atom is constructed, from here on out, what's written might seem like a strange language.
We start from the s orbital and continue, so we have
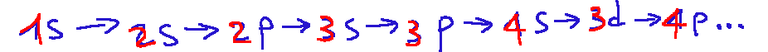
This explains why, for example, the 4s orbital fills up before the 3d orbital.
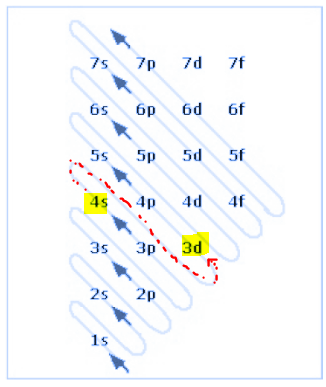
I show this more clearly in the image below.
Exercise
Let's try to determine the electronic configuration of the argon atom (Ar, atomic number 18).
The diagonal rule for this question is shown below.

We know that the sum of electrons, for Ar, is z=18, with the sum being:
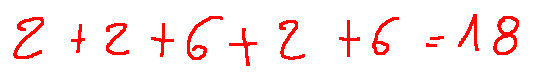
We can then construct this table:

Therefore, the electronic configuration of the argon (Ar) atom is It is as follows:
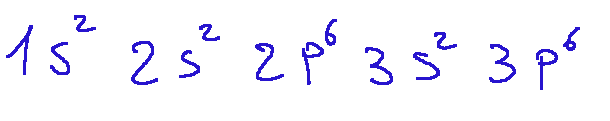
Quantum Numbers
Let's start by recalling the definition of a quantum number. This is a numerical value that describes the energy and spatial state of an electron in an atom.
-1-
The principal quantum number is n and indicates the energy level (example: n=1, 2, 3...).
-2-
The secondary quantum number determines the shape of the orbital (it can be p, d, f, etc.).
-3-
The magnetic quantum number 𝑚𝑙 gives information about the spatial orientation of the orbital.
-4-
The spin quantum number 𝑚𝑠 refers to the intrinsic spin moment of the electron and can only take two values: -1/2 or +1/2.
We can say that to describe an atom, we need a sort of code made up of four quantum numbers n, l, ml, ms
If n=4
The second quantum number can take the values 0, 1, 2, 3,..., (n-1), because the secondary quantum number determines the type of orbital (s, p, d, f...) and its values depend on the principal quantum number n, which I described earlier.
So if we have n=4, it means that it's possible to have 16 orbitals.
n is the principal number, as I explained before, and it determines the energy level and the number of possible sublevels from l=0 to l=n-1.
So for n=4, we have the following table.

Total orbitals = 1 + 3 + 5 + 7 = 16
if n=2
With n=2, how many orbitals is it possible to have?
Going back to the previous table and isolating only what interests us, we get the following:

So 1+3=4
Conclusions
The electronic configuration of an atom is important for understanding its stability, chemical properties, and physical properties. The role of electronic configuration in materials technology is extremely important for determining the electronic properties and behavior of semiconductors.
Question
Have you ever heard of the German physicist Kurt M. Madelung? Did you know that he derived the Madelung rule (or diagonal rule) and the Madelung constant? Did you know that Madelung was a student of Arnold Sommerfeld (one of the fathers of quantum physics)?

ITALIAN

25-08-2025-Tecnologie dei materiali - Configurazione elettronica [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(codice lezione/articolo: QE_02)

immagine creata con l’intelligenza artificiale, il software usato è Microsoft Copilot
Introduzione
Quando siamo nell'ambito delle tecnologie dei materiali, quando parliamo di configurazione elettronica, ci riferiamo a come sono distribuiti gli elettroni nei diversi livelli e sottolivelli energetici attorno al nucleo di un atomo.
Qui di seguito alcuni aspetti tecnici a riguardo della configurazione elettronica.
Regola della diagonale
La regola della diagonale, conosciuta anche come regola di Madelung, è una regola che viene utilizzata anche in chimica e fisica atomica per stabilire l'ordine di riempimento degli orbitali elettronici.
Nota: un orbitale elettronico è una regione dello spazio intorno al nucleo dove è più probabile trovare un elettrone. Colgo l'occasione per ribadire che l'elettrone all'interno dell'orbitale non segue una traiettoria fissa.
Qui di seguito un esempio della regola di Madelung

In questa immagine vediamo che dei numeri formano delle righe, e questi rappresentano gli orbitali atomici. Le sigle s,p,d,f sono le sigle dei vari orbitali (possono essere di tipo s,p,d o f) affiancate dda un numero che è il numero quantico principale.
L'altra cosa che notiamo bene sono le frecce diagonali. Queste indicano l’ordine con cui gli elettroni vanno a riempire i vari orbitali.
E adesso arriva la parte più tecnica della regola della diagonale (o regola di Madelung).
Il principio base di questa regola è che in questo schema si dispongono negli orbitali seguendo il principio dell’energia minima: prima occupano i livelli a energia più bassa, poi quelli a energia più alta. La sequenza di riempimento dipende dalla somma n+1, ovvero numero quantico principale + numero quantico secondario.
Ammetto che se mancano le basi di come è costituito un atomo, da qui in poi, ciò che è scritto potrebbe sembrare una lingua strana.
Si parte dall'orbitale s per poi proseguire, quindi avremo
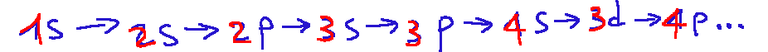
Questo spiega perché ad esempio il 4s si riempie prima del 3d.
Mostro più chiaramente questa cosa nell'immagine qui sotto.

Esercizio
Proviamo a determinare la configurazione elettronica dell'atomo di argon (Ar, numero atomico 18)
Qui di seguito è mostrata la regola della diagonale relativa alla questione

Sappiamo che la somma di elettroni, per quanto riguarda Ar è z=18, con la somma così composta:
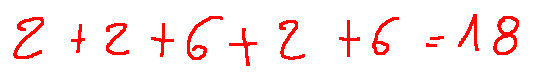
Quindi possiamo arrivare a comporre questa tabella:

Quindi la configurazione elettronica dell’atomo di argon (Ar) è la seguente:
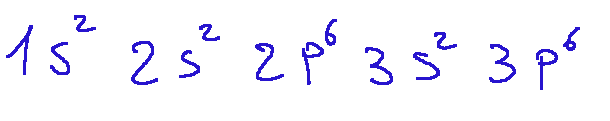
Numeri quantici
Partiamo con il ricordare a definizione di un numero quantico. Questo è un valore numerico che descrive lo stato energetico e spaziale di un elettrone in un atomo.
-1-
Il numero quantico principale è n ed indica il livello energetico (esempio n=1,2,3...).
-2-
Il numero quantico secondario determina la forma dell'orbitale (può essere, p, d, f, …).
-3-
Numero quantico magnetico 𝑚𝑙 da indicazioni riguardo l’orientamento spaziale dell’orbitale.
-4-
Numero quantico di spin 𝑚𝑠 riguarda il momento di rotazione intrinseco dell’elettrone è può assumere solo due valori -1/2 oppure +1/2
Possiamo dire che per descrivere un atomo abbiamo bisogno di una sorta di codice formato da 4 numeri quantici n, l, ml, ms
Se n=4
Il secondo numero quantico può assumere i valori 0, 1, 2, 3,..., (n-1), perché il numero quantico secondario determina il tipo di orbitale (s, p, d, f...) ed i suoi valori dipendono dal numero quantico principale n, che ho descritto prima.
Quindi se abbiamo che n=4 vuol dire che è possibile avere 16 orbitali
n è il numero principale, come ho spiegato prima, e determina il livello energetico è il numero di sottolivelli possibili da l=0 a l=n-1
Quindi per n=4 abbiamo la seguente tabella

Totale orbitali = 1 + 3 +5 + 7 = 16
se n=2
Con n=2, quanti orbitali è possibile avere?
Andando a riprendere la tabella di prima e isolando solo quello che ci interessa avremo quanto segue:

Quindi 1+3=4
Conclusioni
La configurazione elettronica di un atomo è importante per comprendere la stabilità dell'atomo, le proprietà chimiche e le proprietà fisiche, mentre il ruolo della configurazione elettronica nella tecnologia dei materiali è di estrema importanza per determinare le proprietà elettroniche e il comportamento dei semiconduttori.
Domanda
Avevate già sentito parlare del fisico tedesco Kurt M. Madelung? Lo sapevate che da lui deriva la regola di Madelung (o regola della diagonale) e la costante di Madelung? Lo sapevate che Madelung fu un'allievo di Arnold Sommerfeld (uno dei padri della fisica quantistica)?
THE END

