
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
24-03-2025 - Chemistry Basics - Thermodynamics (part 3) [EN]-[IT]
With this post I would like to give a brief instruction about the topic mentioned in the subject
(code notes: X_71)
Thermodynamics (part 3)
Introduction
Chemistry and thermodynamics are closely related because their connection is fundamental to understanding how chemical processes occur and how energy is transferred and transformed during these reactions. During chemical reactions changes occur and thermodynamics explains how molecules can react during these changes.
The molecules of a solid behave differently from the molecules of a gas, in hot and cold the molecules react differently. Thermodynamics helps you understand these mechanisms.
Enthalpy
In thermodynamics an important concept is that of enthalpy.
The expression of the first law of thermodynamics ΔU=Q+L, valid for closed systems, takes on a particularly simple form if instead of internal energy we use an auxiliary state function, namely Enthalpy. The formula for enthalpy is:
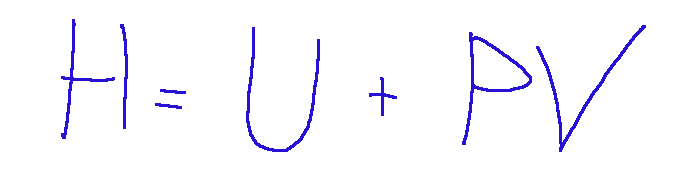
Where:
U = the internal energy of the system
p = the pressure of the system.
V = the volume of the system.
Reasoning about enthalpy and the basics of thermodynamics we can deduce that the change in enthalpy is equal to the sum of heat exchanged during a transformation and a VdP term. Let's go into a bit more detail but in this case it is necessary. If the process occurs at constant pressure it turns out that dP=0 so the first law of thermodynamics would have an extremely simple formula, A formula that could be useful considering that most chemical processes occur at constant pressure.
Mathematically it would look like this
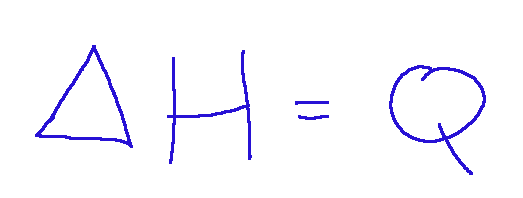
State transition
A thermodynamic transformation in which a system passes from one state of aggregation to another is called a state transition or phase transition. In this type of transformation, there is a sudden change in one or more properties of the substance in correspondence with specific values of the state variables (e.g. temperature).
We can take the state transition of liquid water as an example. It becomes steam at a temperature of 100 °C if the pressure is 1 atm. Still referring to water, its solidification temperature is 0 °C at 1 atm (temperature at which another state transition occurs).
From ice to liquid
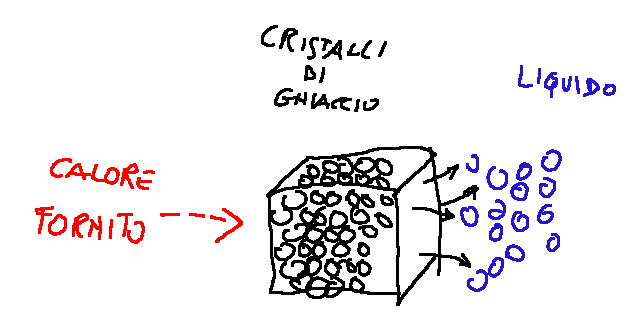
During the two state transitions (fusion, evaporation, ...) the temperature does not change. Let's take ice as an example.
Ice is made up of water molecules arranged according to a crystalline lattice. The heat supplied serves to break the lattice itself and free the water molecules and not to increase the kinetic energy of the "free" water molecules (which would instead translate into an increase in temperature). The amount of energy necessary to allow the state transition to the unit of mass of substance is called latent heat (of fusion, evaporation, condensation, sublimation).
Exercise
When cooling ice from 273 to 263 K, the average kinetic energy of water molecules:
a)
Decreases
b)
Increases
c)
Does not change
d)
Varies randomly
explanation
When we cool ice, remember that 273 K corresponds to 0°C, the average kinetic energy of water molecules decreases. All this happens because the temperature is related to the average kinetic energy of the molecules. The relationship between temperature and kinetic energy is that temperature is a directly proportional link, the lower the temperature, the lower the kinetic energy of the molecules becomes.
From this we can deduce that by reducing the temperature, the average kinetic energy of the molecules decreases.
Conclusions
Thermodynamics studies changes in state and these can influence chemical reactions, since they modify the arrangement and interaction of molecules, making certain transformations more or less favorable.
Question
We have all seen ice melt into water or water become steam, but have any of you ever seen iron or glass melt (become liquid)?

[ITALIAN]
24-03-2025 - Basi di chimica - Termodinamica (part 3) [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_71)
Termodinamica (part 3)
Introduzione
La chimica e la termodinamica sono strettamente correlate perchè il loro legame è fondamentale per comprendere come avvengono i processi chimici e come l'energia si trasferisce e si trasforma durante queste reazioni. Durante le reazioni chimiche avvengono dei cambiamenti e la termodinamica ci spiega come possono reagire le molecole durante questi cambiamenti.
Le molecole di un solido si comportano diversamente dalle molecole di un gas, al caldo e al freddo le molecole reagiscono diversamente. La termodinamica di aiuta a comprendere questi meccanismi.
Entalpia
In termodinamica un concetto importante è quello dell'entalpia.
L'espressione del primo principio della termodinamica ΔU=Q+L, valida per i sistemi chiusi, assume una forma particolarmente semplice se al posto dell'energia interna si utilizza una funzione di stato ausiliaria, ovvero l'Entalpia. La formula dell'entalpia è:
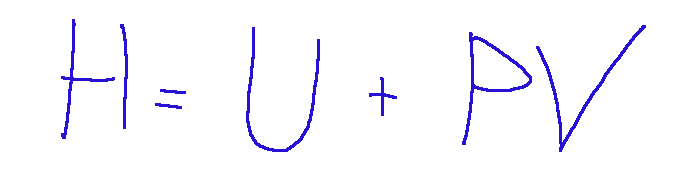
Dove:
U = l'energia interna del sistema
p = la pressione del sistema.
V = il volume del sistema.
Ragionando sull'entalpia e sulle basi della termodinamica possiamo dedurre che la variazione di entalpia è uguale alla somma di calore scambiato durante una trasformazione e un termine VdP. Entriamo un po' nel dettaglio ma in questo caso serve. Se il processo avviene a pressione costante risulta che dP=0 per cui il primo principio della termodinamica avrebbe una formula estremamente semplice, Una formula che potrebbe risultare utile considerando che la maggior parte dei processi chimici avviene a pressione costante.
A livello matematico risulterebbe così
Il passaggio di stato
Una trasformazione termodinamica in cui un sistema passa da uno stato di aggregazione ad un altro si chiama passaggio di stato o transizione di fase. In questo tipo di trasformazioni si verifica il brusco cambiamento di una o più proprietà della sostanza in corrispondenza di specifici valori delle variabili di stato (es. la temperatura).
Possiamo prendere come esempio il passaggio di stato dell’acqua liquida. Essa diventa vapore alla temperatura di 100 °C se la pressione è di 1 atm. Sempre con riferimento all’acqua, la sua temperatura di solidificazione è 0 °C a 1 atm (temperatura in cui avviene un altro passaggio di stato).
Da ghiaccio a liquido
Durante le due transizioni di stato (fusione, evaporazione,…) la temperatura non cambia. Prendiamo come esempio il ghiaccio.
Il ghiaccio è costituito da molecole di acqua ordinate secondo un reticolo cristallino. Il calore fornito serve per rompere il reticolo stesso e liberare le molecole di acqua e non per aumentare l’energia cinetica delle molecole di acqua «libere» (che si tradurrebbe, invece, in un incremento di temperatura). La quantità di energia necessaria a consentire la transizione di stato all’unità di massa di sostanza si chiama calore latente (di fusione, di evaporazione, di condensazione, di sublimazione).

Esercizio
Raffreddando il ghiaccio da 273 a 263 K, l’energia cinetica media delle molecole di acqua:
a)
Diminuisce
b)
Aumenta
c)
Non varia
d)
Varia casualmente
svolgimento
Quando raffreddiamo il ghiaccio, ricordiamo che 273 K corrispondono a 0°C, l'energia cinetica media delle molecole di acqua diminuisce. Tutto questo succede perché la temperatura è legata all'energia cinetica media delle molecole. La relazione che c'è tra temperatura ed energia cinetica è che la temperatura è un legame direttamente proporzionale più si abbassa la temperatura e minore diventa l'energia cinetica delle molecole.
Da questo possiamo dedurre che riducendo la temperatura, l'energia cinetica media delle molecole diminuisce.
Conclusioni
La termodinamica studia i cambiamenti di stato e questi possono influenzare le reazioni chimiche, poiché modificano la disposizione e l'interazione delle molecole, rendendo più o meno favorevoli determinate trasformazioni.
Domanda
Tutti noi abbiamo visto il ghiaccio sciogliersi in acqua oppure l'acqua diventare vapore, ma qualcuno di voi ha mai visto il ferro oppure il vetro fondere (diventare liquido)?
THE END
