
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
22-01-2024 - Physics - gas: ideal, generic real, specific real [EN]-[IT]
The three gas models: ideal, generic real, specific real
Ideal gases
By gas we mean a gaseous form of any substance. By gaseous we mean that particular state of matter, in which a substance is gaseous and has an indeterminate volume and shape.
Ideal gases
Ideal gases at constant specific heats are characterized by two relationships
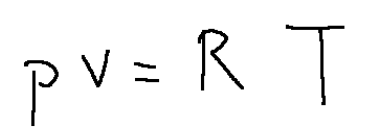
Where:
p = pressure
v = volume
R = universal gas constant
T = absolute temperature
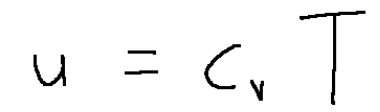
Where:
C v = specific heat of the gas at constant volume
T = absolute temperature
Generic real gases
Under some conditions most gases have P and/or V which cannot be
carefully calculated with the ideal gas laws.
The non-ideal behavior of a gas is more significant at high pressures (P) and/or low temperatures (Y). This corresponds to conditions close to those of the liquefaction of the gas itself.
Generic real gases are characterized by the following relationships
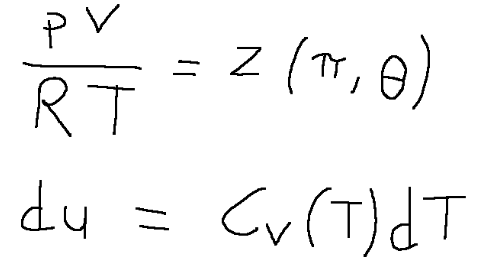
Where:
z = compressibility factor and is normally less than 1
π = reduced pressure;
θ = T/Tc is called the reduced temperature.
Specific real gases
For specific real gases, the geometry and polarities of the molecule of the particular real gas being studied are taken into account. This is also called the Pitzer acentric factor. The acentric Pitzer factor is identified with ω (lowercase omega)
The specific real gas relationship is as follows:
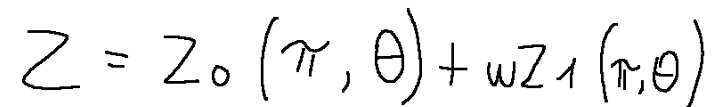
Where:
ω = function of the substance that constitutes the gas
Z 0 = value available from table
Z 1 = value available from table
Conclusions
When some hypotheses formulated to describe a perfect gas no longer exist, we enter the descriptive field of the behavior of a real gas
Request
The study of ideal gases is relatively simple, while I find that of real gases rather difficult. What do you think about it? Have you tried in the past to study or do exercises on real gases?

22-01-2024 - Fisica - gas: ideale, reale generico, reale specifico [EN]-[IT]
I tre modelli dei gas: ideale, reale generico, reale specifico
Gas ideali
Per gas intendiamo un aeriforme di qualsiasi sostanza. Per aeriforme intendiamo quel particolare stato della materia, nel quale una sostanza è gassosa ed ha volume e forma indeterminati.
Gas ideali
I gas ideali a calori specifici costanti sono caratterizzati da due relazioni
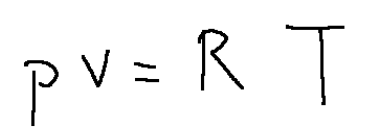
dove:
p = pressione
v = volume
R = costante universale dei gas
T = temperatura assoluta
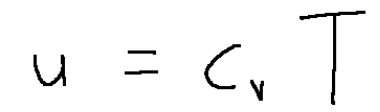
dove:
C v = calore specifico del gas a volume costante
T = temperatura assoluta
Gas reali generici
In alcune condizioni la maggior parte dei gas hanno P e/o V che non possono essere
accuratamente calcolati con le leggi dei gas ideali.
Il comportamento non ideale di un gas è più significativo a pressioni (P) elevate e/o a temperature (Y) basse. Questo corrisponde alle condizioni prossime a quelle della liquefazione del gas stesso.
I gas reali generici sono caratterizzati dalle seguenti relazioni
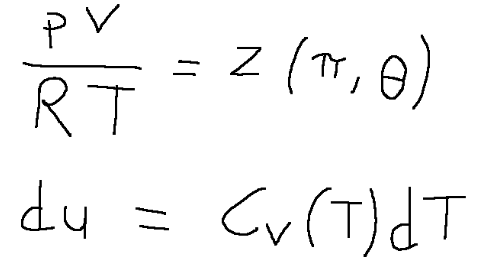
Dove:
z = fattore di comprimibilità ed è normalmente minore di 1
π = pressione ridotta;
θ = T/Tc è detta temperatura ridotta.
Gas reali specifici
Per i gas reali specifici si tiene conto della geometria e delle polarità della molecola del particolare gas reale che si sta studiando. Questo viene chiamato anche fattore acentrico si Pitzer. Il fattore acentrico di Pitzer viene identificato con ω (omega minuscola)
La relazione dei gas reali specifici è la seguente:
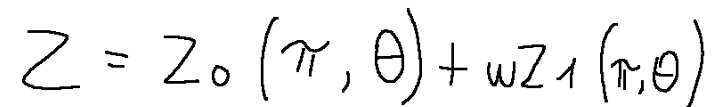
Dove:
ω = funzione della sostanza che costituisce il gas
Z 0 = valore disponibile da tabella
Z 1 = valore disponibile da tabella
Conclusioni
Quando alcune ipotesi formulate per descrivere un gas perfetto vengono a meno entriamo nel campo descrittivo del comportamento di un gas reale
Domanda
Lo studio dei gas ideali è relativamente semplice, mentre quello dei gas reali lo trovo piuttosto difficile. Voi cosa ne pensate? Avete provato in passato a studiare o a fare degli esercizi sui gas reali?
THE END


