
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
21-03-2025 - Chemistry Basics - Thermodynamics [EN]-[IT]
With this post I would like to give a brief instruction about the topic mentioned in the subject
(code notes: X_72)
Thermodynamics
Image generated with AI, software used Microsoft Copilot.
Introduction
Thermodynamics and chemistry are certainly interconnected. Thermodynamics is the branch of physics that studies energy transformations and its main concepts are energy and heat.
During chemical reactions, energy is transferred and transformed and thermodynamics helps us understand these processes, furthermore thermodynamics provides tools to analyze chemical equilibria.
To analyze chemical equilibria we need tools and these tools are always provided by thermodynamics.
Definition of thermodynamic transformations
-A thermodynamic transformation that occurs at constant temperature is called isothermal
-A thermodynamic transformation that occurs at constant pressure is called isobaric
-A thermodynamic transformation that occurs at constant volume is called isochoric
-A thermodynamic transformation that occurs without heat exchange is called adiabatic
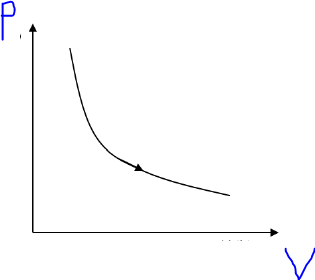
Example of isothermal transformation
A gas enclosed in a cylinder and piston can expand isothermally and during the expansion the volume increases. When the volume decreases we speak of compression.
In this case the following relations are valid

We can deduce that during an isothermal transformation of an ideal gas the product pressure x volume is constant. This means that the pairs P (pressure), V (volume) are on a branch of an equilateral hyperbola.
Example given below.
Example of an isobaric transformation
The most classic example to explain an isobaric transformation (occurs at constant pressure) is the following.
Suppose we change the temperature of the gas while maintaining the pressure constant by placing weights on the piston. If the final temperature is higher than the initial temperature, there is heating, while if the final temperature is lower than the initial temperature, there is cooling.
On the P,V (pressure-volume) plane, this transformation is made up of a horizontal section. We will have isobaric heating if the temperature increases, while we will have cooling in the opposite case.
From what we have said, we understand that in isobaric heating the final volume will be greater than the initial one.
Volume work
In the thermodynamic field, we speak of volume work when we are faced with work done by a system when its volume changes under the action of an external pressure. Volume work is also called expansion work.
Volume work is expressed by the following formula:
W = -PΔV
Where:
P = constant external pressure
ΔV = the change in volume of the system
In the formula above we see a negative sign. This negative sign indicates that work is done by the system on the environment when the volume increases. If the volume decreases, work is done on the environment by the system.
Work is measured in joules, while volume is expressed in m^3.
Heat capacity
Heat capacity is a parameter that changes depending on the element we are studying.
Suppose we are asked to calculate how much heat must be supplied to 30 L of water to bring its temperature from 25°C to 70°C. To answer the question, we need to know a parameter called heat capacity of water, which represents the amount of heat needed to raise the temperature of one gram of substance (water in this case) by 1 K.
Internal energy
For an ideal gas, internal energy is a function only of temperature: U=U(T)
Exercise
Let's try to describe an exercise without going into detail and all the steps. Let's do an exercise just to understand how we can handle the formulas that revolve around thermodynamics.
Let's start....
By reducing the volume of an ideal monatomic gaseous system, keeping the pressure fixed at 101.3 kPa, the system releases 20 kJ to the environment. By how much must the volume decrease so that the pressure of the system does not change?
development
The first thing to take into account is the formula for the change in volume:
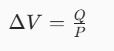
Where:
Q = heat released
P = pressure
At this point we will have 20 kJ / 101.3 kPa
which corresponds to 20000j / 101300 Pa
which is equal to 0.197 m^3
Conclusions
Thermodynamics and chemistry are two interconnected subjects because thermodynamics is the branch of physics that studies how energy is transferred and transformed during chemical reactions.
Question
We said that a thermodynamic transformation that occurs at constant pressure is called isobaric, did you know that in refrigeration and air conditioning systems refrigerant fluids undergo isobaric transformations during some phases of the process?

[ITALIAN]
21-03-2025 - Basi di chimica - Termodinamica [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_72)
Termodinamica

Immagine generata con IA, software usato Microsoft Copilot.
Introduzione
La termodinamica e la chimica sono certamente interconnesse tra loro. La termodinamica è la branca della fisica che studia le trasformazioni energetiche ed i suoi concetti principali sono l'energia ed il calore.
Durante le reazioni chimiche l'energia viene trasferita e trasformata e la termodinamica ci aiuta a comprendere questi processi, inoltre la termodinamica fornisce strumenti per analizzare gli equilibri chimici.
Per analizzare gli equilibri chimici abbiamo bisogno di strumenti e questi strumenti ce li fornisce sempre la termodinamica.
Definizione delle trasformazioni termodinamiche
-Una trasformazione termodinamica che avviene a temperatura costante si dice isoterma
-Una trasformazione termodinamica che avviene a pressione costante si dice isobara
-Una trasformazione termodinamica che avviene a volume costante si dice isocora
-Una trasformazione termodinamica che avviene senza scambio di calore si dice adiabatica
Esempio trasformazione isoterma
Un gas racchiuso in un cilindro e pistone può espandersi isotermicamente e durante l'espansione il volume aumenta. Quando il volume diminuisce parliamo di compressione.
In questo caso valgono le seguenti relazioni

Possiamo dedurre che durante una trasformazione isoterma di un gas ideale il prodotto pressione x volume è costante. Questo vuol dire che le coppie P (pressione), V (volume) si trovano su un ramo di iperbole equilatera.
Esempio qui sotto riportato.

Esempio trasformazione isobara
L'esempio più classico per spiegare la trasformazione isobara (avviene a pressione costante) è il seguente.
Supponiamo di modificare la temperatura del gas mantenendo la pressione costante mettendo dei pesi sul pistone. Se la temperatura finale è maggiore della temperatura iniziale, si ha un riscaldamento mentre se la temperatura finale è minore della temperatura iniziale si ha un raffreddamento.
Sul piano P,V (pressione volume), questa trasformazione, è costituita da un tratto orizzontale. Avremo un riscaldamento isobaro se la temperatura aumenta, mentre avremo un raffreddamento nel caso opposto.
Da ciò che abbiamo detto comprendiamo che nel riscaldamento isobaro il volume finale sarà maggiore di quello iniziale.
Il lavoro di volume
In ambito termodinamico parliamo di lavoro di volume quando siamo davanti ad un lavoro compiuto da un sistema quando cambia il suo volume sotto l'azione di una pressione esterna. Il lavoro di volume viene anche chiamato lavoro di espansione.
Il lavoro di volume è espresso dalla seguente formula:
W = -PΔV
Dove:
P = pressione esterna costante
ΔV = la variazione di volume del sistema
Nella formula qui sopra vediamo un segno negativo. Questo segno negativo indica che il lavoro è fatto dal sistema sull'ambiente quando il volume aumenta. Se il volume diminuisce il lavoro è fatto sull'ambiente dal sistema.
Il lavoro si misura in joule, mentre il volume viene espresso in m^3.
Capacità termica
La capacità termica è un parametro che cambia a seconda dell'elemento che stiamo studiando.
Supponiamo che ci venga chiesto di calcolare quanto calore bisogna fornire a 30 L di acqua per portarne la temperatura da 25°C a 70°C. Per rispondere alla domanda è necessario conoscere un parametro che si chiama capacità termica dell’acqua e che rappresenta la quantità di calore per innalzare di 1 K la temperatura di un grammo di sostanza (l’acqua in questo caso).
Energia interna
Per un gas ideale l’energia interna è funzione solo della temperatura: U=U(T)
Esercizio
Proviamo a descrivere un esercizio senza entrare nei dettagli ed in tutti i passaggi. Facciamo un esercizio solo allo scopo di capire come possiamo gestire le formule che ruotano attorno alla termodinamica.
Partiamo....
Riducendo il volume di un sistema gassoso ideale monoatomico, mantenendo la pressione fissa a 101.3 kPa, il sistema cede 20 kJ all’ambiente. Di quanto deve diminuire il volume perché la pressione del sistema non cambi?
svolgimento
La prima cosa da tenere in considerazione è la formula della variazione di volume:
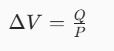
Dove:
Q = calore ceduto
P = la pressione
A questo punto avremo 20 kJ / 101.3 kPa
che corrisponde a 20000j / 101300 Pa
che è uguale a 0,197 m^3
Conclusioni
La termodinamica e la chimica sono due materie interconnesse perché la termodinamica è quel ramo della fisica che studia come l'energia viene trasferita e trasformata durante le reazioni chimiche.
Domanda
Abbiamo detto che una trasformazione termodinamica che avviene a pressione costante si dice isobara, lo sapevate che nei sistemi di refrigerazione e climatizzazione i fluidi refrigeranti subiscono trasformazioni isobare durante alcune fasi del processo?
THE END
