
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
06-02-2025 - Chemistry Basics - Planetary Model [EN]-[IT]
With this post I would like to give a brief instruction on the topic mentioned in the subject
(code notes: X_96)
Planetary Model
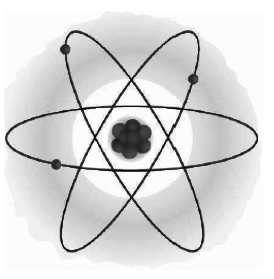
In chemistry one of the most famous people is the scientist Rutherford.
Ernest Rutherford was a New Zealand physicist naturalized British, and is considered by many to be the father of nuclear physics.
His most famous experiment is the one performed with the gold foil that allowed the scientist to discover the atomic nucleus.
Rutherford managed to understand that an atom is essentially empty. The mass is almost entirely concentrated in the positively charged nucleus made up of protons and neutrons.
The electrons, equal in number to the protons, are attracted to them with an electrostatic force given by Coulomb's law
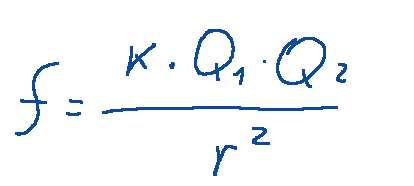
Where
-𝑓 is the force between the two charges.
-𝑘 is the Coulomb constant
-Q1 and Q2 are the amounts of charge of the two particles.
-r is the distance between the two charges.
All this can have a strong analogy with the planetary model, in which the planets orbit the sun on elliptical orbits with the sun at one focus, electrons should orbit the nucleus according to similar orbits, thanks to the close similarity between Coulomb's law and Newton's law of universal gravitation.
So the planetary model of the atom was a turning point when we talk about atomic science. After this idea the next brilliant intuition comes from Bohr.
According to Bohr's atomic model, electrons can only occupy certain quantized energy levels and move on defined stationary orbits around the nucleus. When an electron jumps from one orbit to another, energy is absorbed or released in discrete quantities, called quanta.
The energy and orbits of electrons, according to Bohr, vary discontinuously.
Let's go back to Rutherford's atomic model.
Rutherford's model of the atom postulated that electrons revolve around the nucleus like planets revolve around the sun. According to the laws of classical physics, however, this model had a problem.
Electrons, in their circular motion, should emit electromagnetic energy due to centripetal acceleration. By emitting energy, electrons would lose kinetic energy, slow down, and, as a result, should spiral toward the nucleus, collapsing into it.
Essentially, in the planetary model of the atom, electrons, in their motion, should emit electromagnetic energy at the expense of their own motion, so, sooner or later, they should collapse into the nucleus.
Photoelectric effect
The photoelectric effect played a crucial role in the development of the theory of the atom and quantum physics.
-The photoelectric effect provided experimental evidence that the energy of light is quantized
-The photoelectric effect demonstrated that light can behave both as a particle (photon) and as a wave.
The photoelectric effect could not be explained by classical physics, which predicted that the energy of the emitted electrons increased with the intensity of the light. However, experiments showed that the energy of the emitted electrons depended only on the frequency of the light and not on its intensity.
In the photoelectric effect, the kinetic energy of electrons emitted by a metal is given by:
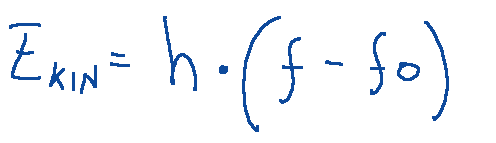
Where:
-ℎ is Planck's constant.
-𝑓 is the frequency of the incident radiation.
-𝑓0 is the threshold frequency of the metal, below which no electron emission occurs.
Conclusions
Rutherford's planetary model introduced the idea of a central, dense, positively charged nucleus around which electrons rotate. This theory replaced the idea of J.J. Thomson's "panettone" model.
Question
Was the name Rutherford in your memory? Do you remember studying it in school?

[ITALIAN]
06-02-2025 - Basi di chimica - Modello planetario [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_96)
Modello planetario

In chimica uno dei personaggi più conosciuti è lo scienziato Rutherford.
Ernest Rutherford era un fisico neozelandese naturalizzato britannico, e da molti è considerato il padre della fisica nucleare.
Il suo esperimento più conosciuto è quello eseguito con la lamina d'oro che permise alla scienziato di scoprire il nucleo atomico.
Rutherford riuscì a capire che un atomo è essenzialmente vuoto. La massa è quasi interamente concentrata nel nucleo di carica positiva costituito da protoni e neutroni.
Gli elettroni, in numero pari ai protoni, sono attratti da questi con una forza elettrostatica data dalla legge di Coulomb
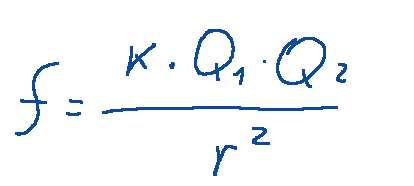
Dove
-𝑓 è la forza tra le due cariche.
-𝑘 è la costante di Coulomb
-Q1 e Q2 sono le quantità di carica delle due particelle.
-r è la distanza tra le due cariche.
Tutto questo può avere una forte analogia con il modello planetario, in cui i pianeti orbitano intorno al sole su orbite ellittiche di cui il sole occupa uno dei fuochi, gli elettroni dovrebbero orbitare intorno al nucleo secondo orbite simili, grazie alla stretta somiglianza tra la legge di Coulomb e la legge della gravitazione universale di Newton.
Quindi il modello planetario dell'atomo è stato un punto di svolta quando parliamo della scienza atomica. Dopo questa idea la prossima intuizione geniale arriva da Bohr.
Secondo il modello atomico di Bohr, gli elettroni possono occupare solo determinati livelli di energia quantizzati e si muovono su orbite stazionarie definite intorno al nucleo. Quando un elettrone salta da un'orbita all'altra, l'energia viene assorbita o rilasciata in quantità discrete, chiamate quanti.
L’energia e le orbite degli elettroni, secondo Bohr, variano in modo discontinuo.
Torniamo al modello atomico di Rutherford.
Il modello atomico di Rutherford postulava che gli elettroni ruotano intorno al nucleo come i pianeti ruotano intorno al sole. Secondo le leggi della fisica classica però questo modello aveva un problema.
Gli elettroni, nel loro movimento circolare, dovrebbero emettere energia elettromagnetica a causa dell'accelerazione centripeta. Emettendo energia, gli elettroni perderebbero energia cinetica, rallenterebbero e, di conseguenza, dovrebbero spiraleggiare verso il nucleo, collassando su di esso.
Sostanzialmente, nel modello planetario dell'atomo, gli elettroni, nel loro movimento, dovrebbero emettere energia elettromagnetica a spese del proprio movimento per cui, prima o poi, dovrebbero collassare sul nucleo.
Effetto fotoelettrico
L'effetto fotoelettrico ha giocato un ruolo cruciale nello sviluppo della teoria dell'atomo e della fisica quantistica.
-L'effetto fotoelettrico ha fornito prove sperimentali che l'energia della luce è quantizzata
-L'effetto fotoelettrico ha dimostrato che la luce può comportarsi sia come particella (fotone) che come onda.
L'effetto fotoelettrico non poteva essere spiegato dalla fisica classica, che prevedeva che l'energia degli elettroni emessi aumentasse con l'intensità della luce. Tuttavia, gli esperimenti mostrarono che l'energia degli elettroni emessi dipendeva solo dalla frequenza della luce e non dalla sua intensità.
Nell'effetto fotoelettrico l'energia cinetica degli elettroni emessi da un metallo è data da:
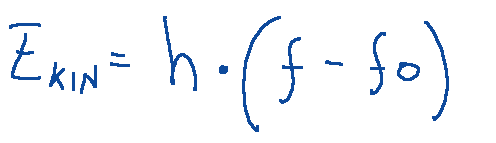
Dove:
-ℎ è la costante di Planck.
-𝑓 è la frequenza della radiazione incidente.
-𝑓0 è la frequenza di soglia del metallo, sotto la quale non si verifica l'emissione di elettroni.
Conclusioni
Il modello planetario di Rutherford ha introdotto l'idea di un nucleo centrale, denso e carico positivamente, attorno al quale ruotano gli elettroni. Questa teoria sostituì l'idea del modello "panettone" di J.J. Thomson.
Domanda
Il nome Rutherford era nella vostra memoria? Ricordate di averlo studiato a scuola?
THE END
